PROPRIETATI CHIMICE
- Apa poate reacţiona cu o serie de substanţe simple sau compuse, în reacţii fără modificarea stării de oxidare (cu oxizi acizi, cu oxizi bazici, în reacţiile de hidroliză etc.) sau în reacţii cu modificarea stării de oxidare (cu metale, cu nemetale etc.).
A) Reacţii fără modificarea stării de oxidare:
a) H2O + oxizi acizi (oxizi nemetalici) 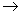 acizi
acizi
H2O + CO2 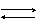 H2CO3 H2O + SO2
H2CO3 H2O + SO2 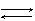 H2SO3
H2SO3
- Prin reacţia apei cu o serie de poluanţi din aer (SO2, SO3, oxizi de azot) se formează acizi, apa ajungând pe suprafaţa pământului “încărcată” cu acizii respectivi subformă de “ploaie acidă”.
b) H2O + oxizi bazici (oxizi metalici) 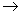 hidroxizi
hidroxizi
H2O + Na2O = 2NaOH H2O + CaO = Ca(OH)2
c) Reacţii de hidroliză :
3H2O + AlCl3 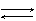 Al(OH)3 + 3(H+ + Cl-) ,
Al(OH)3 + 3(H+ + Cl-) ,
soluţia apoasă are caracter acid
2H2O + Na2CO3 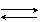 2(Na+ + HO-) + H2CO3 ,
2(Na+ + HO-) + H2CO3 ,
soluţia apoasă are caracter bazic
2H2O + (NH4)2CO3 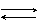 2NH4OH + H2CO3 ,
2NH4OH + H2CO3 ,
soluţia apoasă are caracter aproximativ neutru
- Ca urmare a fenomenului de hidroliză se poate explica de ce soluţiile unor săruri prezintă caracter acid sau bazic.
- Nu hidrolizează sărurile care provin din neutralizarea unui acid tare cu o bază tare cum sunt NaCl, KI, NaNO3, K2SO4 şi altele de acelaşi tip. La introducere în apă, aceste săruri se dizolvă punând în libertate ionii aferenţi dar nu reacţionează chimic cu apa. Soluţiile acestor săruri sunt neutre:
NaCl + H2O 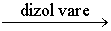 Na+ + Cl- + H2O,
Na+ + Cl- + H2O,
soluţia apoasă prezintă caracter neutru
d) Alte tipuri de reacţii cu substanţe anorganice
2Ni + 2H2O + O2 = 2Ni(OH)2
e) Reacţii cu compuşi organici
- Reacţiile apei cu unii compuşi organici, numite tot reacţii de hidroliză, se desfăşoară lent la temperatura camerei de aceea compuşii organici sunt – în marea lor majoritate – dizolvaţi fizic sau “înglobaţi” în apă, ca particule coloidale, fără modificarea structurii lor chimice. Pentru ca reacţiile de hidroliză să aibă loc se impun condiţii mai severe de reacţie (temperatură, presiune) şi/sau catalizatori. Este şi cazul reacţiei de hidroliză a esterilor. Dacă se supun hidrolizei, în mediu bazic, esteri ai acizilor graşi cu glicerina numiţi grăsimi, reacţia are drept consecinţă obţinerea de săruri ale acizilor graşi cu diferiţi atomi metalici, numite săpunuri.
H2O + R-CO-O-R1  R-COOH + R1-OH
R-COOH + R1-OH
ester acid alcool
B) Reacţii cu modificarea stării de oxidare
- La temperaturi mari, apa se descompune în hidrogen şi în oxigen. Aceeaşi reacţie poate avea loc la temperatura camerei prin electroliza apei slab acidulate sau alcalinizate.
H2O 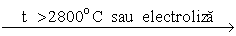 H2 + ½ O2
H2 + ½ O2
Apa poate participa la reacţii de reducere sau de oxidare, schematic ilustrate mai jos:
H0  1e+ + H+ 1e+ + H+
|
OII - - 2e-  O0 O0
|
Reducere
H2O are caracter oxidant
|
Oxidare
H2O are caracter reducător
|
H 2O + C = CO + H2
|
|
4H2O(V) + 3Feinroşit =Fe3O4 +4H2
|
H2O + Cl2 = O + 2HCl
|
H2O + Fe = FeO + H2
|
H2O + F2 = O + 2HF
|
2H2O + Fe = Fe(OH)2 + H2
|
2 H2O + 2Na = 2NaOH + H2
|
- Oxigenul atomic rezultat în reacţia apei cu halogeni este deosebit de reactiv, şi poate distruge microorganismele din apă. Pe această proprietate se bazează tratarea biologică a apei potabile cu clor.
- Acţiunea apei asupra metalelor are ca efect distrugerea acestora. Fenomenul poartă numele de coroziune.
- Apa este un electrolit foarte slab.În apa pură şi în soluţiile apoase există echilibrul:
H2O + H2O 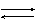 H3O+ + HO-
H3O+ + HO-

